近期,中科院合肥研究院健康所戴海明團隊在細胞凋亡研究領(lǐng)域取得了重要進(jìn)展,揭示了細胞促凋亡蛋白BAK全新的激活位點(diǎn),BMF和HRK能夠直接結合在BAK蛋白α4、α6和α7螺旋形成的溝槽上,這是一個(gè)之前沒(méi)發(fā)現的新激活位點(diǎn)。該項研究不僅進(jìn)一步完善了細胞凋亡的激活機制,而且為進(jìn)一步以BAK為靶點(diǎn)研發(fā)誘導細胞凋亡的靶向藥物提供了新的可能。
由BCL2家族蛋白介導的線(xiàn)粒體途徑凋亡是細胞凋亡的主要調控方式。其中,BAK和BAX是線(xiàn)粒體膜通透的主要執行者。在受到BH3-only蛋白激活后,BAK和BAX能夠形成多聚,并引起線(xiàn)粒體外膜的穿孔,從而誘導細胞色素c等物質(zhì)的釋放,激活caspase級聯(lián)反應,導致細胞凋亡的發(fā)生。脅迫條件能夠誘導BH3-only蛋白的顯著(zhù)上調,從而直接或間接激活BAK或BAX。目前已發(fā)現的BH3-only蛋白主要包括BIM、PUMA、tBID、NOXA、BAD、BMF、HRK以及BIK。之前的研究表明,BIM、PUMA和tBID能夠直接通過(guò)經(jīng)典的BH3結合口袋與BAK結合,從而激活BAK。然而,其他BH3-only蛋白如BMF、HRK和BIK等,能否直接激活BAK還不清楚。
該研究團隊不僅在分子及細胞水平證實(shí)BMF和HRK能夠直接激活BAK,而且發(fā)現, 相對于BIM、PUMA和tBID與BAK的經(jīng)典結合模式,BMF和HRK能夠直接結合BAK的另一個(gè)結合位點(diǎn),從而直接激活BAK。通過(guò)蛋白質(zhì)核磁共振和分子動(dòng)力學(xué)模擬等研究發(fā)現,BMF和HRK能夠直接結合在BAK蛋白α4、α6和α7螺旋形成的溝槽上,而這是一個(gè)之前沒(méi)發(fā)現的新激活位點(diǎn)。進(jìn)一步通過(guò)點(diǎn)突變、脂質(zhì)體模擬以及細胞內研究發(fā)現,新結合位點(diǎn)中的一些關(guān)鍵氨基酸的突變能夠顯著(zhù)降低BMF/HRK與BAK的結合能力,降低BAK穿膜和誘導細胞凋亡的能力,從而進(jìn)一步證明新的BAK的BH3蛋白結合位點(diǎn)對于BMF和HRK介導的細胞凋亡具有重要作用。
該研究中,戴海明團隊的葉開(kāi)琴助理研究員為第一作者。研究是與美國梅奧醫學(xué)院Scott Kaufmann教授,Yuan-Ping Pang教授課題組合作完成,研究還得到了中科院合肥研究院強磁場(chǎng)科學(xué)中心(穩態(tài)強磁場(chǎng)實(shí)驗裝置(SHMFF)),鄭州輕工業(yè)大學(xué)等單位的協(xié)助。研究在國家自然科學(xué)基金、合肥研究院院長(cháng)基金(火花基金)等項目的資助下完成。
文章鏈接:https://doi.org/10.1038/s41467-020-17074-y
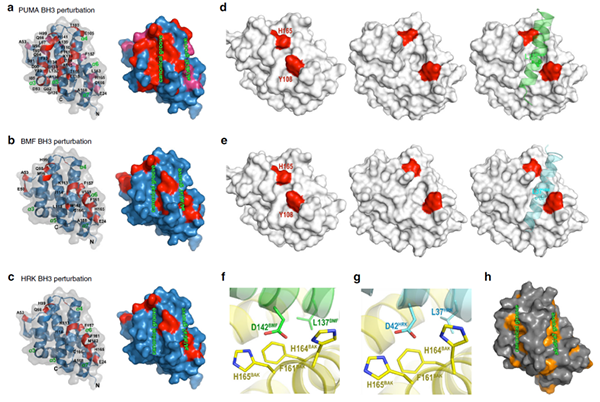
BMF及HRK激活BAK依賴(lài)于新位點(diǎn) (a4/ a6/ a7溝槽),與PUMA激活BAK的經(jīng)典位點(diǎn)不同。
其中a-c是PUMA, BMF, HRK的BH3小肽利用蛋白質(zhì)核磁共振研究相互作用示意圖;d-e是分子動(dòng)力學(xué)模擬的結果示意圖;f-g顯示BAK F161在相互作用中起重要作用;h顯示了BAK疏水表面。
