近日,中國科學(xué)院合肥物質(zhì)院健康所蔣焱熠團隊與南加州大學(xué)De-Chen Lin團隊合作研究發(fā)現,鱗癌中的主轉錄因子TP63通過(guò)抑制IFNγ-STAT1信號通路,促進(jìn)了腫瘤的免疫逃逸。在小鼠體內模型中,下調TP63表達,顯著(zhù)增強了PD-1抗體的抗腫瘤免疫療效。新進(jìn)展發(fā)表在Nature Communications?上。
鱗狀細胞癌(以下簡(jiǎn)稱(chēng)“鱗癌”)是一種常見(jiàn)的侵襲性惡性腫瘤,目前臨床治療仍缺少有效的靶向治療方法。近年來(lái),免疫療法特別是靶向PD-1/PD-L1通路的免疫檢查點(diǎn)阻斷(ICB)療法,已在鱗癌患者中取得了顯著(zhù)的療效。然而,僅有少數鱗癌患者(~20-40%)從中受益。特別是表現為“免疫冷”表型的患者,對ICB療法不響應或復發(fā)。因此,深入了解鱗癌的免疫逃逸機制,將有助于開(kāi)發(fā)免疫療效響應性分子標志物和潛在的免疫治療增效策略。
研究人員通過(guò)深入分析鱗癌患者樣本、癌細胞系及TP63敲降后的轉錄數據,觀(guān)察到TP63的表達對干擾素-γ/α(IFNγ/α)等免疫信號通路產(chǎn)生了明顯的抑制作用。在進(jìn)一步的研究中,利用小鼠模型、單細胞RNA測序及體外共培養技術(shù),他們發(fā)現降低TP63的表達能顯著(zhù)增加CD8+ T細胞的腫瘤浸潤,并強化這些細胞的腫瘤殺傷能力。同時(shí),臨床研究數據也顯示,TP63的表達水平與CD8+ T細胞的浸潤和活化程度呈負相關(guān)。
值得注意的是,研究還發(fā)現下調TP63可以顯著(zhù)提升PD-1抗體在抗腫瘤免疫治療中的效果。通過(guò)綜合運用單細胞轉錄組學(xué)、表觀(guān)遺傳學(xué)和生物化學(xué)方法,研究人員揭示了TP63與STAT1之間存在一種相互抑制的調控機制。這種機制通過(guò)共同調節各自的啟動(dòng)子和增強子在轉錄水平上實(shí)現相互抑制,二者的相對表達量作為IFNγ信號通路的“開(kāi)關(guān)”,調控下游干擾素刺激基因的表達,進(jìn)而影響CD8+ T細胞的活性和鱗癌腫瘤的免疫響應。
這項研究不僅揭示了TP63在促進(jìn)鱗癌細胞逃避免疫監視中的重要作用,還提出了一個(gè)潛在的免疫治療增效策略。未來(lái),TP63的表達水平有可能成為預測鱗癌免疫治療效果的生物標志物,而抑制TP63則可能是一種將“免疫冷”腫瘤轉變?yōu)椤懊庖邿帷蹦[瘤的有效方法,通過(guò)靶向TP63/STAT1/IFNγ軸,有望增強鱗癌患者的ICB免疫治療療效。
中國科學(xué)院合肥物質(zhì)院副研究員蔣遠、中山大學(xué)附屬第七醫院副研究員鄭悅媛、中國科學(xué)院合肥物質(zhì)院項目研究員張遠偉和博士生孔帥為論文的并列第一作者;中國科學(xué)院合肥物質(zhì)院研究員蔣焱熠和南加州大學(xué)終身助理教授De-Chen Lin為該論文的并列通訊作者。錫達爾西奈醫學(xué)中心的H. Phillip Koeffler教授和北京協(xié)和醫學(xué)院腫瘤醫院王明榮教授團隊為本研究做出了重要貢獻。該項研究得到了國家自然科學(xué)基金、安徽省自然科學(xué)基金、分子腫瘤學(xué)國家重點(diǎn)實(shí)驗室開(kāi)放課題、DeGregorio Family Foundation和合肥物質(zhì)院院長(cháng)基金的支持。
原文鏈接:https://doi.org/10.1038/s41467-024-46785-9
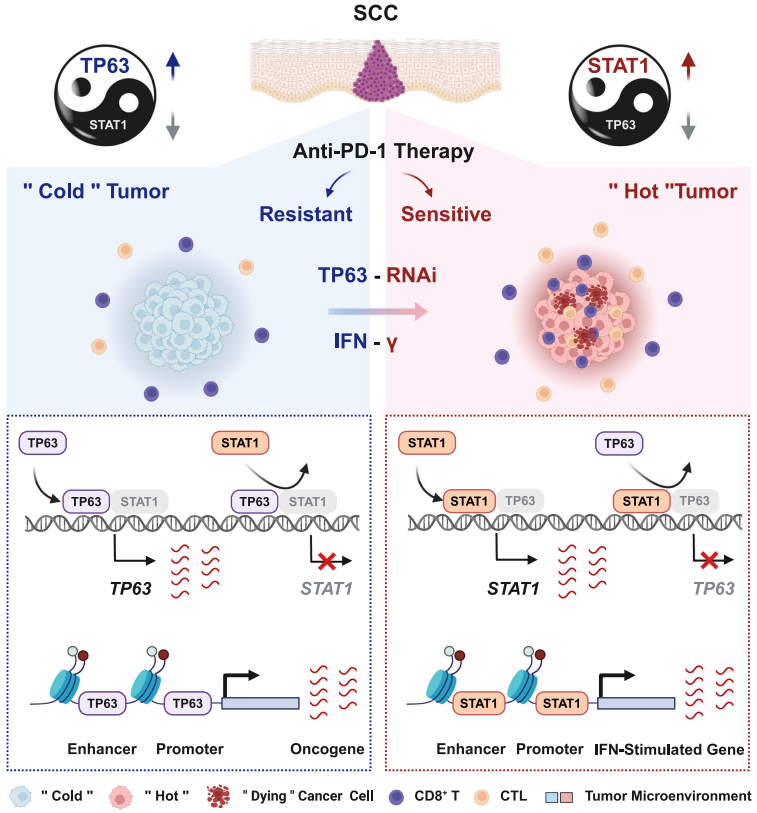
TP63抑制鱗癌免疫應答的模式圖
